来源:百蓁生物发布时间:2025-08-01浏览量:43次
急性髓系白血病(AML)作为一种侵袭性血液肿瘤,化疗后易复发、预后差,传统治疗手段面临巨大挑战。近年来,免疫治疗通过激活T细胞识别肿瘤细胞表面的MHC相关肽(MAPs)展现出潜力,但AML突变负荷低、肿瘤特异性抗原(TSAs)稀缺且患者特异性强,严重限制了治疗应用,在此背景下,非编码区来源的非经典MHC相关肽(ncMAPs)成为研究焦点。这类抗原由长链非编码RNA(lncRNA)、假基因等非编码区域异常翻译产生,可能为AML免疫治疗提供全新靶点。
2024年,发表于Scientific Data的研究“MHC-I-presented non-canonical antigens expand the cancer immunotherapy targets in acute myeloid leukemia”系统阐述了AML中的免疫肽组景观,通过整合多组学数据,构建475782个非经典开放阅读框(ncORFs),结合人类蛋白质组(UniProt),从19例AML患者的质谱(MS/MS)数据中,鉴定出6426个经典免疫肽(cMAPs)和1838个非经典免疫肽(ncMAPs),并探索其与免疫细胞浸润的关联,证实了ncMAPs可作为高效、共享的肿瘤新抗原,为精准治疗奠定基础。

该研究通过整合RPFdb、nuORFdb和TransLnc数据库的核糖体测序(Ribo-seq)数据,筛选出475782个非经典开放阅读框(ncORFs),结合人类蛋白质组(UniProt),从19例AML患者的质谱(MS/MS)数据鉴定出免疫肽;通过MixMHCpred、MHCflurry、NetMHCpan三种工具预测肽段与MHC的结合能力,仅保留至少两种工具验证阳性的肽段作为主要组织相容性复合体相关肽(MAPs);基于转录组数据将候选抗原分为肿瘤特异性抗原(TSAs)、异常表达抗原(aeTSAs)和癌睾抗原(CTAs),排除在正常组织中表达或结合MHC的肽段;以新抗原来源基因的表达量、患者生存时间及状态为输入,通过lasso回归计算风险评分,评估其对1年、3年、5年生存率的预测性能。
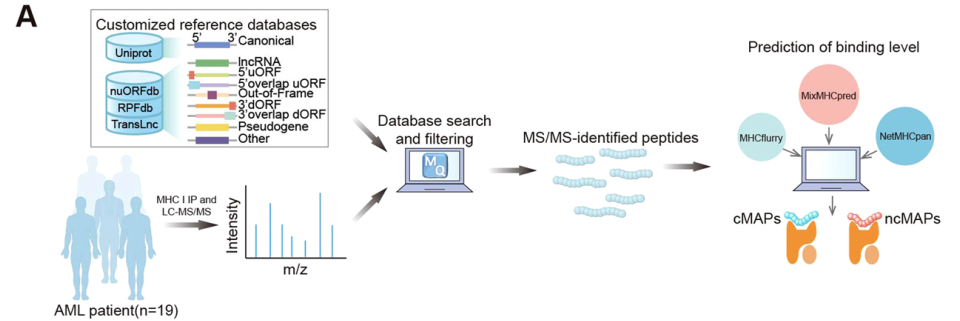
图:cMAPs和ncMAPs鉴定的工作流程
1. ncMAPs是不可或缺的肿瘤新抗原
本研究共鉴定出6426个cMAPs和1838个ncMAPs,ncMAPs在MHC结合亲和力(尤其HLA-A和C等位基因)、T细胞接触疏水性等关键指标上与cMAPs相当甚至更优,提示更强的免疫原性;约66.27%的ncMAPs在至少2例患者中共享,为跨患者治疗提供可能(图1)。
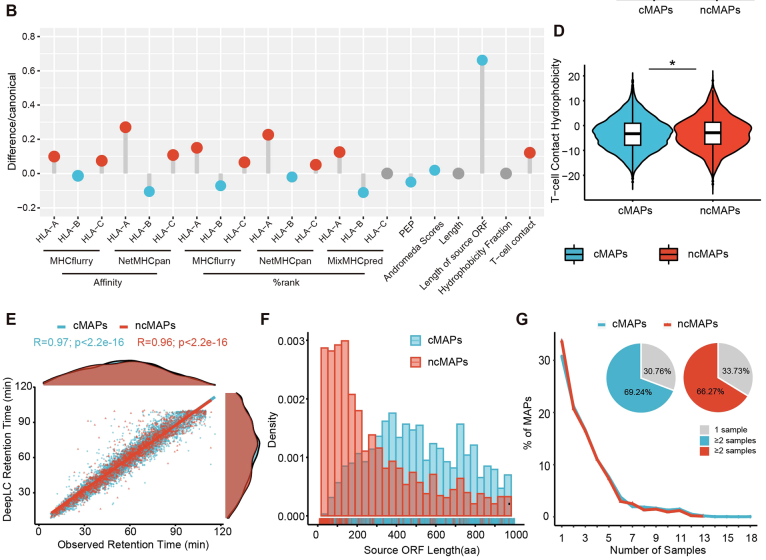
图1. ncMAPs 和 cMAPs 不同特征的比较
2. 源基因产生 ncMAPs 的更高生成效率
研究发现ncMAPs主要源于lncRNA(39.95%)、3' 重叠区(19.86%)和5' 非翻译区(15.78%)。尽管其来源基因的表达水平较低,但生成抗原的效率(免疫肽组中检测到的氨基酸占来源蛋白的比例)显著高于cMAPs 来源基因(图2)。
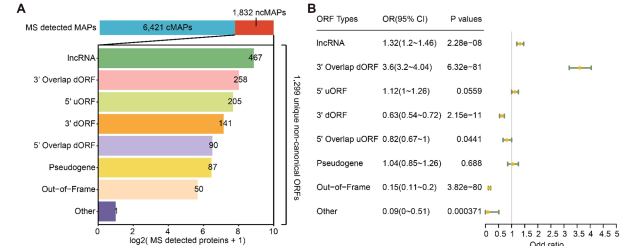
图2. 编码ncMAPs和cMAPs的源蛋白的比较
3. AML患者中共享抗原基序分析
通过分析抗原在不同急性髓系白血病(AML)患者间的分布规律、与HLA等位基因的关联及肽段基序的共享特征,发现HLA-A、B、C 等位基因的累积覆盖率分别达90.3%、76.1%、94.0%,且患者间共享的HLA等位基因越多,MAPs重叠度越高(图3),通过对肽段序列的基序分析,结果鉴定出254个肽段亚基序,有 188个亚基序可在多个HLA等位基因中存在,有助于设计高人群覆盖率的疫苗。
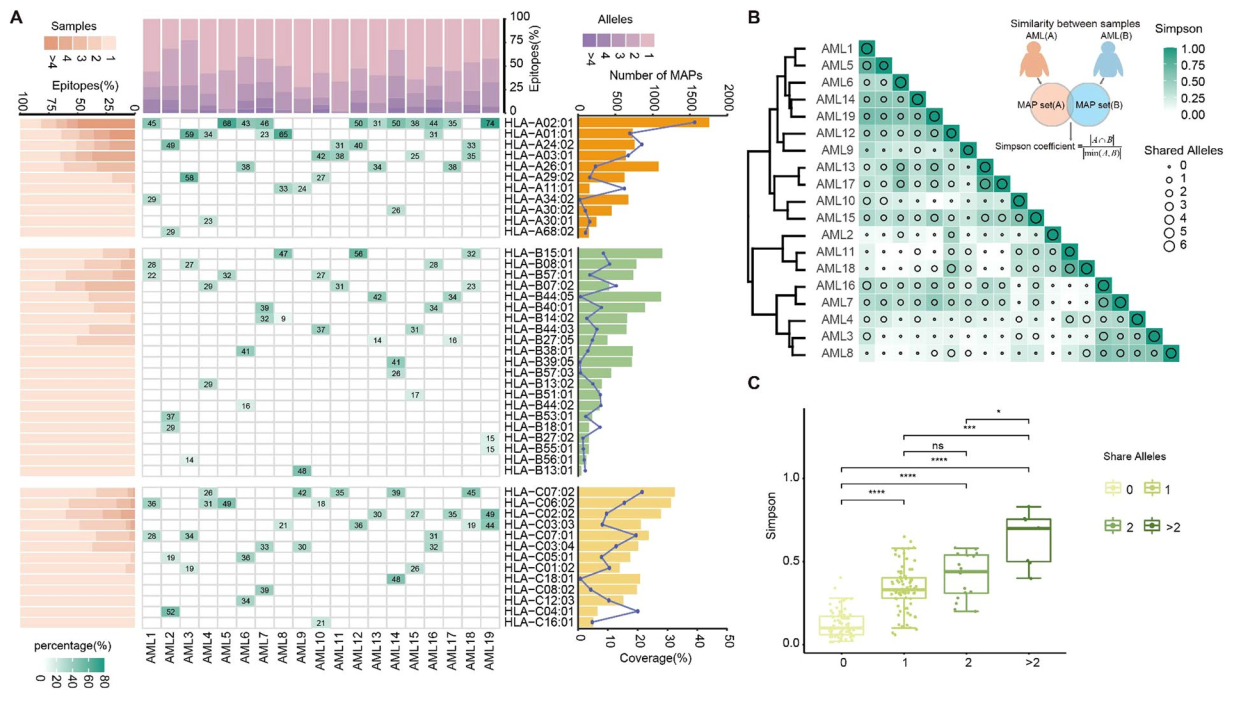
图3.急性髓系白血病(AML)患者中新抗原(MAPs)的分布情况
4.新抗原筛选
研究者通过整合肿瘤与正常组织的转录组和免疫肽组数据,最终筛选出13个优先新抗原,6个来自ncMAPs,且均不在正常组织中表达,安全性高。新抗原 ILPSYQLFL与HLA-A02:01结合稳定,质谱验证可信度高(PEP=0.029,Andromeda 评分 91.07),具有强免疫原性(图4)。
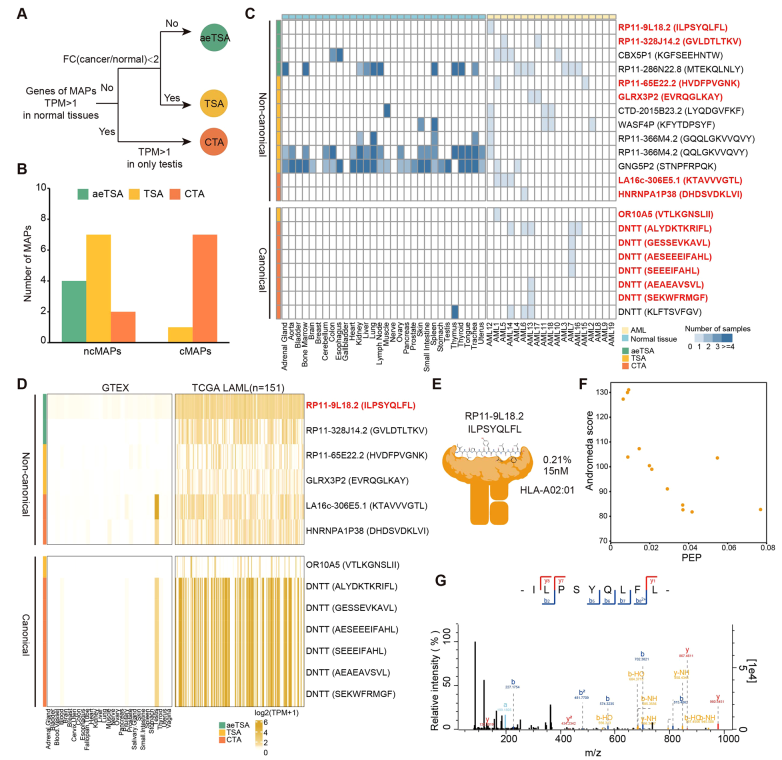
图4. 综合多层次组学分析准确识别肿瘤特异性抗原
5.免疫关联与预后模型
新抗原相关基因的表达与免疫细胞(如CD4+/CD8+T细胞、树突状细胞)浸润显著相关。基于这些基因构建的风险模型对1年、3年、5年生存率的预测AUC分别为0.631、0.65、0.729,高风险组与免疫逃逸通路(如 WNT-β-catenin)激活相关。
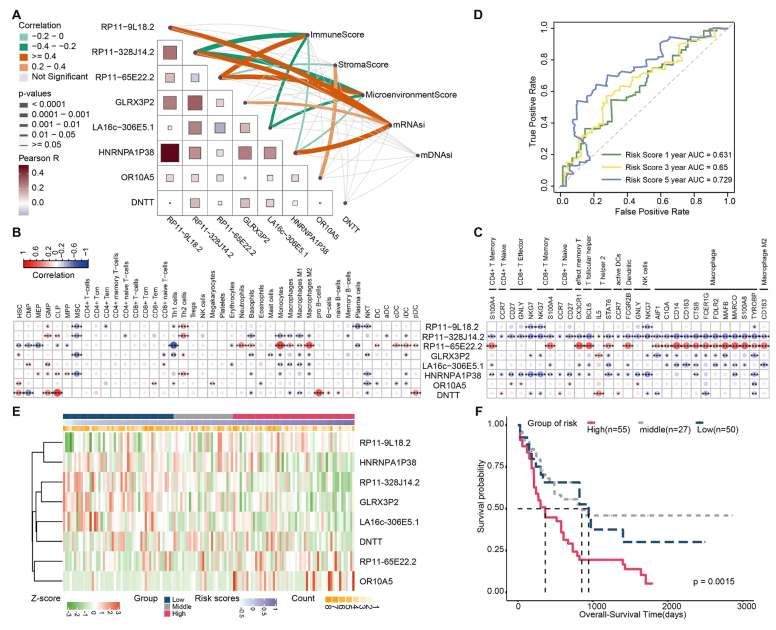
图5. 新抗原与免疫逃逸及预后的关联
本研究证实,非经典抗原(ncMAPs)是急性髓系白血病 (AML)中不可或缺的肿瘤新抗原来源,其特性优异、共享性高且生成高效,可显著扩展免疫治疗靶点库。通过多组学整合筛选出的新抗原兼具特异性与免疫原性,基于其构建的风险模型为临床预后评估提供了可靠工具。这些发现不仅为急性髓系白血病(AML)精准免疫治疗奠定了基础,也为其他癌症中非编码区抗原的研究提供了范式,有望推动肿瘤免疫治疗从“个体化”向“通用化”迈进。