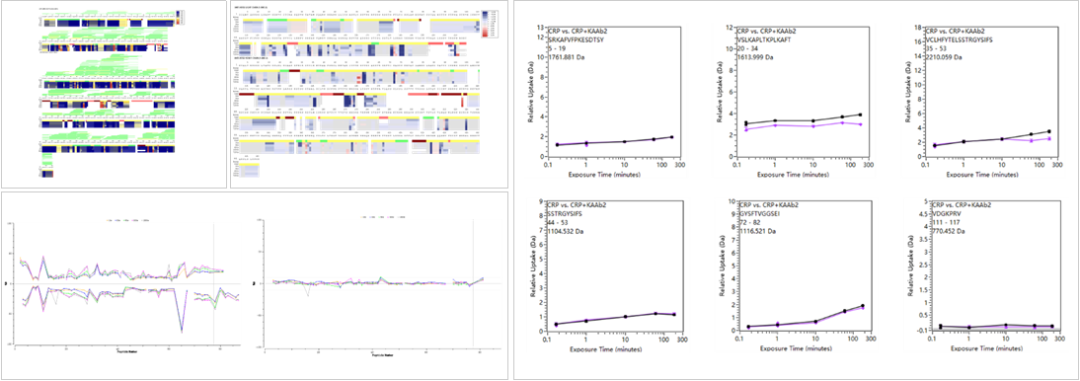
来源:百小蓁发布时间:2024-01-12浏览量:372次
翻译后修饰(Post-translational modification, PTM)可以对蛋白质结构和蛋白质动力学产生深远的影响,从而影响蛋白质的功能。为了理解PTM诱导的功能差异以及变化,需检测构象变化并检测蛋白质变化的特定部分。然而,像抗体这样的大蛋白质的构象分析并不简单,传统的生物物理技术,如圆二色谱、DSC和荧光等提供了有用的信息,但这些技术着眼于整个蛋白质,只能提供全局视图,核磁共振和X射线晶体学可以提供高分辨率的结构分析,但各自都有局限性,这常常使IgG1的构象研究变得困难。随着质谱的发展,氢氘交换质谱(HDX MS)的出现为研究蛋白质空间构象提供了全新技术,其原理是蛋白在重水溶液中,可发生蛋白的氢原子与重水的氘原子的交换反应,蛋白表面酰胺键的氢比蛋白内部或参与蛋白-配体相互作用酰胺键的氢交换速率快,通过质谱检测确定蛋白质不同序列片段的氢氘交换速率,从而获得蛋白空间结构变化的信息。

有研究者使用氢/氘交换质谱对单克隆免疫球蛋白γ1 (IgG1)抗体不同修饰后的功能和构象变化进行了研究,对比差异半乳糖化、蛋氨酸氧化和岩藻糖化对溶液构象的影响,并探讨了IgG1与FcγRIIIa受体结合的影响。结果表明,蛋氨酸氧化和半乳糖化都影响IgG1构象,而岩藻糖化似乎对构象影响较弱。FcγRIIIa结合受到聚糖结构/组成(即半乳糖和岩藻糖)和某些修饰引起的构象变化的强烈影响。此项研究展示了HDX MS在分析单克隆抗体高阶结构和结构动力学方面的惊人潜力。
一、不同修饰的IgG1变体与Fc受体结合活性的研究
研究者利用酶处理、化学修饰或二者结合的方式从天然物质中提取出不同修饰的IgG1变体,使用竞争性结合试验来检测IgG1经不同修饰后是否存在Fc受体结合活性的改变。如图1所示,结果表明,氧化IgG1的结合活性与原生IgG1几乎相同,去岩藻糖的IgG1显示出比原生IgG1强49倍的FcγRIIIa结合(图1B),显示去岩藻糖的IgG1提高了与FcγRIIIa的结合,高半乳糖化的IgG1与FcγRIIIa的相对结合率为高达324%,表明半乳糖化显著增强了IgG1与FcγRIIIa的结合。

图1.不同修饰对FcγRIIIa与IgG1结合的影响
二、不同修饰的IgG1变体对构象的影响的研究
氧化和聚糖修饰都是IgG1常见的修饰,半乳糖化和去岩藻糖化IgG1可以大大增强Fc与FcγRIIIa的结合,但尚不清楚修饰本身如何以及在何种程度上参与了与Fc受体的相互作用,因此确定氧化、岩藻糖化和半乳糖化对构象的影响,并将观察到的构象变化与FcγRIIIa结合活性的变化联系起来是至关重要的。研究者推测高半乳糖化IgG1导致了CH2结构域之间的空间距离最大,可能暴露了更多的氨基酸残基,从而增加了FcγRIIIa的结合强度。通过HDX MS可以对这些假设进行验证,如图2所示,比较242-254区域部分肽段的氢氘交换数据(图2,右下),能够确定导致交换变化的主要主链酰胺氢是在Leu-243、Phe244和/或Lys247残基上,在高半乳糖化形式中(黑色虚线),氘化量最少,去糖基化的IgG1中(红色曲线),三个残基中有更多的氘掺入,意味着氢键的丧失或更多的溶剂暴露,氧化的IgG1(蓝色实线)在243-247区域发现了更多的氘,而高半乳糖化物种也被氧化时(蓝色虚线),交换曲线更像单独氧化时的曲线。基于这些结果,得出结论,氧化削弱了主链酰胺氢键或溶剂保护,而半乳糖化则相反,且IgG1 Fc部分被氧化后的不稳定性比高半乳糖化的更强。结合氧化后的受体结合活性基本上没有变化,但高半乳糖化后的受体结合增强的结论,表明了两种潜在的情况:(a)聚糖,特别是末端半乳糖,本身参与了与FcγRIIIa的相互作用;(b)聚糖的变化引起构象的变化(包括HDX MS无法检测到的变化,例如在保留所有主链酰胺氢环境的情况下,整个结构域的移动),这迫使Fc部分形成更适合于FcγRIIIa结合的构象。
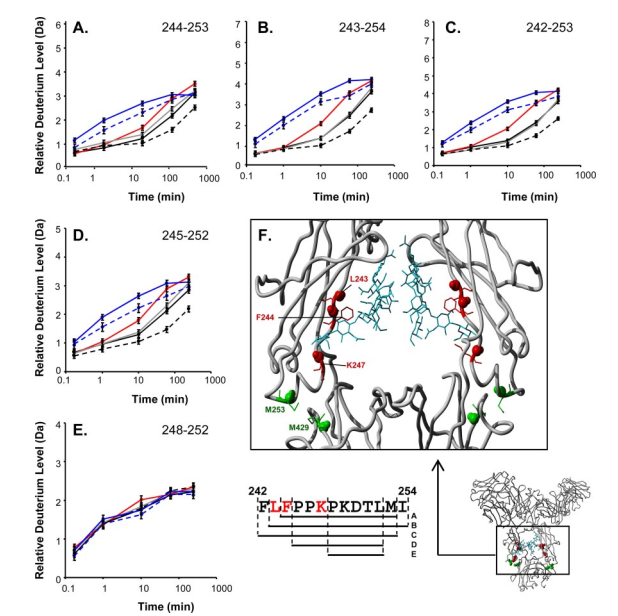
图2. 残基243-247被PTMs的影响。A-E,5个代表性肽段(244-253、243-254、242-253、245 - 252、248-252)的的相对氘水平。在10s、1min、10 min、60 min和240 min监测每种IgG1变体的氘化水平。纯黑色:原生IgG1;纯灰色:脱半乳糖化IgG1;点黑色:高半乳糖化IgG1;纯红色:去糖基化IgG1;固体蓝:蛋氨酸氧化IgG1;蓝色虚线:高半乳糖化蛋氨酸氧化IgG1。
三、不同修饰的IgG1如何影响分子的构象和构象动力学以及影响受体结合
为研究IgG1和FcγRIIIa受体结合时的构象动力学,研究者将不同修饰的IgG1和FcγRIIIa在室温下孵育120 min后进行氢氘交换分析。比较原生IgG1和有FcγRIIIa存在时的氘掺入情况,发现在重链残基157-164、243-247和320-334三个区域在受体存在时表现出不同的氘交换,这些残基在受体存在的情况下都不受氘掺杂的影响(图3);比较去岩藻糖化-高半乳糖化IgG1和有FcγRIIIa存在时的氘掺入情况,发现在重链残基279-301和243-247两个区域在受体存在时表现出不同的氘交换(图4)。在原生IgG1和去岩藻糖化-高半乳糖化IgG1与FcγRIIIa结合之间观察到的差异表明了不同的相互作用模式。
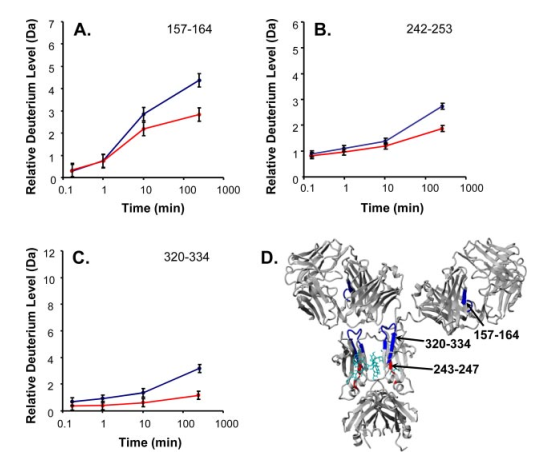
图3. 原生IgG1和与FcRIIIa结合的原生IgG1的氘交换比较。A-C显示了三个重链多肽(157-164,242-253和320-334) 的相对氘化百分比。蓝色为IgG1单独的氘水平,红色为IgG1与FcRIIIa复合体的氘水平。D: IgG1的结构(聚糖为青色,与FcRIIIa相互作用的差异区域为红色或蓝色)
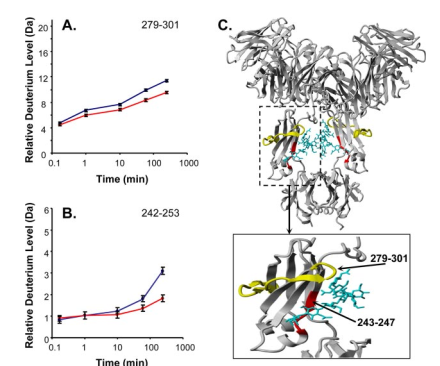
图4. 去岩藻糖化-高半乳糖化IgG1和去岩藻糖化-高半乳糖化与FcRIIIa结合的IgG1的氘水平比较。A-B显示了两个重链多肽279-301 (A)和242-253 (B)的相对氘化百分比。蓝色为IgG1单独的氘水平,红色为IgG1与FcRIIIa复合体的氘水平。C: IgG1的结构(聚糖为青色,与FcRIIIa相互作用的差异区域为红色或黄色)
基于所有HDX MS数据,研究者总结了IgG1的修饰如何影响分子的构象和构象动力学以及影响受体结合(图5)。当IgG1发生高半乳糖化修饰时,氘掺入的主要改变区域是在残基243-247中(图6B),这可能是糖与CH2结构域的这部分氨基酸相互作用方式改变的结果,高半乳糖化引起的CH2结构域的变化影响受体结合,使结合具有更高的亲和力(图1)。
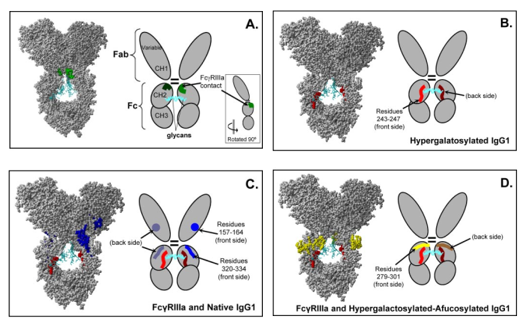
图5. 不同IgG1变体与FcγRIIIa结合的构象影响。A. FcγRIIIa与IgG1相互作用的位置;B.高半乳糖化IgG1与FcγRIIIa结合时,氘交换发生改变的区域;C. 原生IgG1与FcγRIIIa与结合时,氘交换发生改变的区域;D. 去岩藻糖化-高半乳糖化IgG1与FcγRIIIa结合时,氘交换发生改变的区域。
四、结论
抗体与FcγRIIIa结合受到聚糖结构和某些修饰的影响,进一步HDX MS分析发现不同的修饰引起CH2结构域的变化从而影响了受体结合,研究者指出导致结合更紧密的确切机制尚不清楚,但数据表明,构象发生了变化从而影响了活性,或者更可能是构象变化和动力学变化的组合,使该区域变更稳定,并使氘掺入以更慢的速度进行。
优品推荐
百蓁实验平台的优势:
a. 低温精控全自动化样品前处理系统,低回交率,高重现性,高定量准确性;实现秒到小时时间尺度的蛋白质高级结构精确表征;
b. 搭载Thermo Orbitrap超高分辨三合一质谱仪,Top-Down、Middle-Down、Bottom-Up三种分析模式,CID、HCD、ETD多种碎裂方式,提升质谱采集数据广度与覆盖度;
c. 自主PEAKS软件平台深度解析质谱数据,获取更高深度和准确度肽段信息;
HDX-MS 方法的优势:
a. 蛋白质在溶液中处于天然状态而非晶体状态,直接鉴定蛋白复合体构象;
b. 能够进行蛋白质结构动态变化的研究,包括变化中的活性位点及表位;
c. 质谱检测灵敏度高,蛋白质样品用量少(微克级);对样品纯度要求低;质谱分析速度快,极大缩短实验周期。
数据分析与结果呈现的优势:
a. HDExaminer定量分析结合人工校准,精确分析氘掺入量变化趋势,可完成抗体表位分析、抗体批次间差异效应分析、蛋白质相互作用分析、蛋白质-配体相互作用分析、蛋白质动态结构变化分析等多种需求。
b. 多种可视化结果呈现方式,并可以通过pyMOL或Chimera渲染到蛋白质晶体结构,简洁形象。
结果展示